L’appuntamento mensile con la nostra rubrica di divulgazione, curata da Marco Lazzara.
“È più facile spezzare un atomo che un pregiudizio.” (Albert Einstein)
Venuti dal Sub-Universo
Venuti dal Sub-Universo è un racconto scritto da Roman Starzl nel 1928. Racconta di uno scienziato che rimpicciolisce a dimensioni subatomiche la figlia e il genero in modo che i due possano osservare a occhio nudo gli atomi e scoprire come siano fatti. Passato il tempo stabilito li ringrandisce, ma al loro posto compare un gruppo di strane persone, che si rivelano essere i loro discendenti. Come sosteneva Einstein il tempo è relativo, per cui a dimensioni subatomiche pochi minuti erano stati come interi secoli.
Questo racconto è stato scritto nel periodo in cui si cercava di risolvere il problema della struttura atomica e il mondo scientifico era concentrato su questo tema. Il racconto in sé era simpatico, ma da un punto di vista biologico del tutto impossibile: da due soli individui non può nascere un’intera popolazione, la variabilità genetica è troppo bassa, il continuo accoppiamento tra consanguinei genererebbe infatti una razza debole e probabilmente non fertile. Sorvolando su questo dettaglio, ci si potrebbe comunque chiedere cosa avrebbero potuto mangiare e bere i protagonisti.
Ma c’è un altro motivo, ben più pressante. Ve lo svelo alla fine dell’articolo.
Modelli Atomici
Contrariamente a quanto si possa pensare, l’idea di atomo è antichissima, risale addirittura a Democrito (IV secolo a.C.) che ipotizzava l’esistenza di minuscole entità indivisibili, costituenti fondamentali di tutto ciò che esiste (in greco atomos vuol dire appunto indivisibile). Questa idea è stata poi dimenticata fino al XIX secolo, quando è stata ripresa dal chimico inglese John Dalton. Ma come sono fatti questi atomi? Secondo Dalton, erano praticamente uguali a delle palle da biliardo.
Ci volle un secolo perché questa idea venisse messa in discussione. Joseph Thomson, nel corso di un geniale esperimento, scoprì che gli atomi sono a loro volta costituiti da un certo numero di entità ancora più piccole; alcune di queste particelle avevano carica negativa (elettroni) e altre positiva (protoni). Thomson elaborò allora un nuovo modello: una sfera di carica positiva, costituita dai protoni, in cui sono incapsulati gli elettroni (un po’ come i canditi e l’uvetta in un panettone).
Uno degli allievi di Thomson, Ernest Rutherford (premio Nobel per la Chimica nel 1908) non era però convinto. A seguito di un esperimento, dimostrò che nella materia c’è molto spazio vuoto: la maggior parte della massa dell’atomo è infatti concentrata in una zona molto piccola, il nucleo, costituito dai protoni e dai neutroni (particelle a carica nulla, scoperti solo più avanti). Elaborò allora un modello che vedeva gli elettroni ruotare attorno al nucleo lungo orbite fisse. Un modello chiamato “planetario”, perché simile al sistema solare: il nucleo è il sole e gli elettroni i pianeti.
La fisica classica dice però che un modello così non sta in piedi, per un motivo che non mi dilungo a spiegare. A questo punto entra allora in gioco la fisica quantistica: fu Niels Bohr, che ipotizzando che gli atomi fossero soggetti alle sue leggi, che salvò il modello planetario.
Ma per poco. Werner Heisenberg (premio Nobel per la Fisica nel 1932) fa notare che è impossibile determinare con esattezza il moto di un elettrone attorno al nucleo: la misura è infatti affetta da un errore. Capita anche nel mondo di tutti i giorni; ma nel moto di un pallone da calcio o di un pianeta si tratta di un errore trascurabile, nel caso di minuscoli elettroni diventa invece fatale.
Il problema è stato risolto da Erwin Schrödinger e Paul Dirac (premi Nobel per la Fisica nel 1933), con questa idea: se non si può dire con certezza dove si trovi l’elettrone istante per istante, si può almeno dire dov’è più probabile che sia. Si crea quindi una funzione matematica, chiamata orbitale, che indica la probabilità di trovare l’elettrone in una certa regione di spazio. Immaginate una sfera: l’elettrone si trova nello spazio all’interno della sfera con una probabilità del 99,99%. So che parlare di probabilità può sembrare all’apparenza un qualcosa di raffazzonato e aleatorio, invece risolve i problemi citati in precedenza e rende conto dei dati sperimentali. Non è un modello perfetto, certo, ma si possono fare correzioni, e per ora è il migliore che siamo riusciti a produrre.
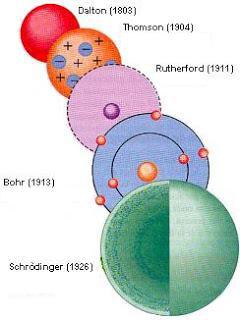
La Struttura degli Atomi
Torniamo al racconto di Starzl. Nel mio libro “Incubi e Meraviglie” (GDS Edizioni), mi sono divertito a scrivere un racconto sullo stesso tema, ma un po’ più realistico. Eccovene un estratto.
[…] Anni di studi e ricerche gli avevano permesso di realizzare uno straordinario macchinario in grado di emettere un fascio di onde elettromagnetiche a bassa frequenza, che oscillando in sincrono con le vibrazioni della materia, permettevano d’ingrandire o rimpicciolire qualunque oggetto mantenendone inalterata la struttura molecolare e senza in alcun modo alterarlo o danneggiarlo. Accese la sua straordinaria macchina che occupava buona parte del laboratorio e si mise sull’apposita piattaforma metallica, quindi attivò il raggio riduttore. […] Alle dimensioni a cui si sarebbe rimpicciolito avrebbe potuto osservare gli atomi a occhio nudo. Al termine del processo il nucleo di un atomo poteva stargli comodamente nel palmo della mano, grande come una biglia.
[…] Riusciva finalmente a vedere i nuclei, con i protoni e i neutroni che vibravano incessantemente, e facendo attenzione riusciva a cogliere gli elettroni sciamare rapidissimi attorno a essi per poi schizzare via lontanissimi. Era un mondo frenetico, sempre in eterno movimento; riusciva persino ad avvertire l’elettricità della loro natura intrinseca. Sarebbe stata la più grande scoperta nella storia dell’umanità! E lui avrebbe vinto il Premio Nobel!
Improvvisamente iniziò a boccheggiare. Che cosa gli stava succedendo? No! Stava soffocando! Com’era possibile? Mentre si accasciava morente al suolo, la risposta gli galleggiò davanti agli occhi: una molecola biatomica, i due nuclei circondati da otto elettroni ciascuno. L’ossigeno era ora troppo grande per i suoi microscopici polmoni.

Come sempre resto a vostra disposizione per eventuali dubbi/chiarimenti/domande varie.
“O fantasia, inestinguibile fonte dalla quale bevono l’artista e lo scienziato! Vivi presso di noi, anche se sei riconosciuta e onorata da pochi, per preservarci dalla cosiddetta ragione, da quel fantasma senza carne e senza sangue.” (Franz Schubert)
